Kryokonservierung von humanen und tierischen Zellen
Das Ziel der Kryokonservierung ist es, Zellen über lange Zeiträume sicher zu lagern, ohne die Risiken einer mikrobiellen Kontamination, einer Kreuzkontamination (mit anderen Zelltypen), genetischen Drifts oder morphologischer Veränderungen einzugehen. Außerdem wird so das Problem der zellulären Seneszenz (Alterung) umgangen: Viele Zellen teilen sich in Kultur nicht unendlich und sterben mit der Zeit ab. Durch das Einfrieren der Zellen wird dieser Prozess unterbrochen.
Bei sehr niedrigen Temperaturen (wir sprechen von -150 bis -196°C!) wird jede enzymatische oder chemische Aktivität wirksam gestoppt und das biologische Material bleibt genetisch stabil und metabolisch inert. Die Kryokonservierung ist somit ein zentraler Prozess in allen Zellkulturlaboren. Eine gut organisierte und ordentlich angelegte Zellbank garantiert dem Labor eine kontinuierliche Versorgung mit funktionsfähigen Zelllinien und dient als Backup für den Fall, dass bei den Experimenten etwas schiefläuft.
Was ist beim Einfrieren von Zellen zu beachten?
Die zu konservierenden Zellen sollten natürlich möglichst vital sein, um den Prozess des Einfrierens und Auftauens bestmöglich verkraften zu können. Optimalerweise werden daher Zellen verwendet, die sich in der exponentiellen Wachstumsphase befinden. Die Zelldichte, bei der die Zellen konserviert werden sollten, variiert mit den Zelltypen; sie sollte aber generell weder zu gering, noch zu hoch sein.
Das Konservieren der Zellen erfolgt in speziellen Einfrier- oder Kryomedien. Diese Medien bestehen klassischerweise aus dem jeweiligen Standard-Kulturmedium, welches mit Serum (FBS) und Gefrierschutzmitteln (Kryo-protektiva) angereichert ist. Allerdings gibt es mittlerweile hervorragende gebrauchsfertige Formulierungen, die auf Serum und andere tierische Bestandteile verzichten und zum Teil sogar chemisch definiert sind. Ein solches Medium ist FREEZin1™.
Um die maximale Lebensfähigkeit während der Kryolagerung zu erhalten, sollten die Zellen mit einer konstanten Geschwindigkeit von -1°C pro Minute heruntergekühlt werden. Durch diese kontrollierte Abkühlrate lassen sich zwei zellschädigende Ereignisse deutlich reduzieren: Die irreversible Dehydratisierung der Zellen (und daraus resultierend ein zellschädigender Konzentrationsanstieg der innerzellulären Elektrolyte) und die intrazelluläre Eiskristallbildung.
Die richtige Einfriergeschwindigkeit ist essentiell, um einen Mittelweg zwischen diesen beiden Problemen einzuschlagen: Geringe, reversible Dehydratisierung der Zellen und die Bildung ausschließlich extrazellulärer Eiskristalle.
Gefrierschutzmittel schützen die Zellen während des Einfrierens vor mechanischem und physikalischem Stress.
Penetrierende (in die Zellen eindringende) Kryoprotektiva wie DMSO und Glycerin reduzieren den Wassergehalt in den Zellen, wodurch die Bildung von intrazellulären Eiskristallen minimiert wird. Gleichzeitig verhindern sie die osmotische Dehydratisierung der Zellen und beugen so hohen Elektrolytkonzentrationen im Zellinneren vor.
Nicht-zellgängige Kryoprotektiva wie Trehalose und Saccharose tragen zur Verbesserung des osmotischen Ungleichgewichts bei und spielen vor allem bei hohen Kühlraten und der Ausverdünnungsphase (Entfernung von Glycerin aus den Zellen) beim Auftauen eine wichtige Rolle.
Im Gegensatz zum Einfrierprozess ist beim Auftauen Schnelligkeit gefragt: Die zellschädigende Wirkung der Gefrierschutzmittel wird durch schnelles Auftauen bei 37°C und sofortiger Verdünnung mit Medium minimiert. Wenn es notwendig ist, die Zellen zu zentrifugieren, sollten sie mit der minimalen g-Kraft sedimentiert werden, um Scherschäden zu vermeiden.
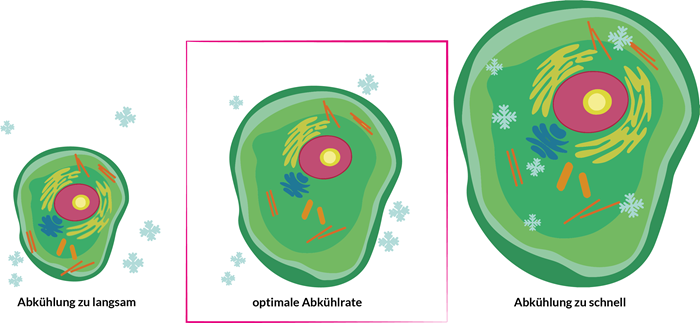
Erfolgreiche Kryokonservierung hängt entscheidend von der Kinetik des Herunterkühlens ab:
Erfolgt die Abkühlung zu langsam, findet eine irreversible Dehydratisierung (sogenannter Lösungseffekt; Schäden durch zu stark konzentrierte Elektrolyte) der Zellen statt (links Abbildung).
Geschieht die Abkühlung zu schnell, kann das Restwasser zellschädigende intrazelluläre Eiskristalle bilden (rechts).
Nur bei einer optimalen Abkühlrate findet die Eiskristallbildung ausschließlich extern statt und die Dehydratisierung der Zelle ist reversibel (mitte).
Unsere Empfehlung: FREEZin1™
FREEZin1™ ist ein serumfreies und chemisch definiertes Einfriermedium für etablierte Zelllinien, Primärzellen und Stammzellen. FREEZin1™ wird unter cGMP-Bedingungen hergestellt und kombiniert Anwenderfreundlichkeit (ready-to-use) mit hervorragender Performance. Besonders empfindliche Zelltypen profitieren von den herausragenden Erholungsraten.
- Gebrauchsfertig
- Ideal für serumfreie Anwendungen und klinische Studien
- Keine Chargenschwankungen aufgrund chemisch definierter Zusammensetzung
- Hervorragende Performance in Bezug auf Vitalzellzahl, Proliferation, Adhärenz und Bioaktivität nach dem Auftauen
- Geeignet für MSCs: Erhalt der Pluripotenz und hohe Wachstumsrate nach dem Auftauen
- Für eine Vielzahl von Zelltypen optimiert und getestet: darunter T-Zellen, beta-Zellen, Hybridomas, humane Endothelzellen, mesenchymale Stammzellen, Blutzellen (Nabelschnur; PBMCs), etablierte Säugerzelllinien wie CHO, MRC-5, HEK-293, HepG2, HeLa, BSC-1, BGM, 3T3, MA-10, BHK-21, B16-F10